标签:效果 信号 结合 影响 需要 优缺点 兴趣 特点 带来
经典的生物研究技术侧重于分子和细胞集群的研究——即研究含有大量相同形态或功能的分子或细胞的活动。但是,这种方法会忽略集群中的单个分子或子群的特异性。事实上在细胞周期的不同阶段或在不同的环境中,单个分子或细胞的活动很可能与集群表现出的整体活动不同。要对单个分子或亚群的活动进行观察,必须严格控制实验条件,保证每个分子的状态相同。
单分子荧光成像技术可以分为两类:一类是在外力作用下研究单分子活动,通常通过原子力显微镜(AFM)、光镊(OT)或磁镊(MT)将力施加到单个分子上。另一类就是用荧光显微成像观察生物系统中单分子活动。
荧光显微成像是生命科学领域观察生物体结构的经典方法。这其中,用荧光探针标记,检测和分析单个分子的单分子荧光成像技术,能够帮助科学家们在不破坏生命体正常生理状态的情况下,清晰地观察到单个分子的活动。
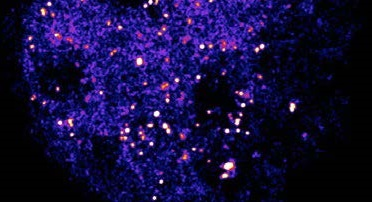
我们常用的宽场显微镜能够同时观察数百个分子和它们之间的相互作用,使研究人员能够轻松地收集到大量数据进行分析,同时还增加了检测到小概率事件的可能性。但是由于它不能排除来自焦平面上下的杂散信号,信噪比较差(图1),对于本身信号已经很弱的单分子荧光来说,宽场成像不是一种好的成像方法。
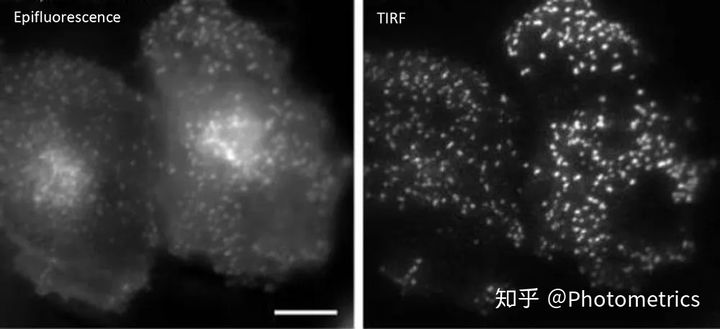
图1 普通荧光和TIRF照明下表达GFP的Hela细胞在同一焦平面的图像。Scale bar: 10 μm
共聚焦显微镜可以克服宽场显微镜的问题,拒绝杂散光,这样就可以只对感兴趣的平面成像。由于共聚焦显微技术的特点,科学家们将它应用于DNA修复等领域,直接观察核苷酸切除修复蛋白与DNA的结合(Segers-Nolten et al. 2002)。
TIRF
全内反射荧光显微镜(TIRF)是单分子荧光成像最常用的方法之一,被用于研究肌动蛋白和肌球蛋白转运动力学(Zimmerman et al.)以及分子扩散(Fujiwara et al.,2016)等。简单来说,TIRF是利用光线全反射后在介质另一面产生衰逝波的特性,使用特定角度的激发光,令所有的光都被反射。这样在全反射区域的另一面就会产生衰逝波,对样本表面的极薄区域(通常在200nm以下)进行照明(图2)。由于衰逝波是呈指数衰减的,只有极靠近全反射面的样本区域会被激发,从而大大降低了背景噪声,提高了信噪比(图1)。TIRF广泛应用于对细胞表面物质的动态观察,如固定在盖玻片或细胞膜表面上的分子等。
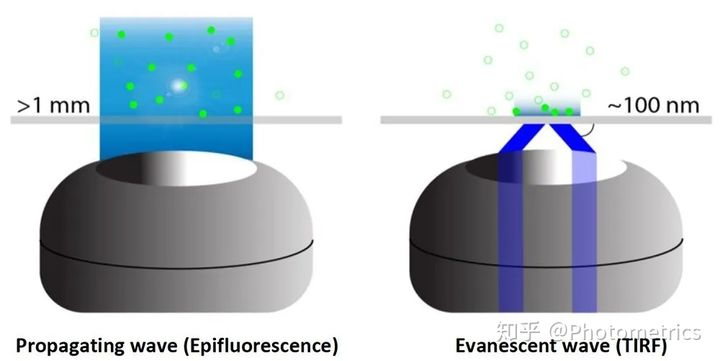
图2 传导波和衰逝波的差别。传导波(propagating wave)以线性方式在组织中传播,可激发深度大于1 mm的荧光基团。由TIRF产生的衰逝波(Evanescent wave),激发深度仅为约100nm
FRET
如果一个荧光分子(供体分子)的发射光谱与另一个荧光分子(受体分子) 的吸收光谱有一定的重叠, 当这两个分子的距离足够近(通常为1-10nm)的时候,供体的荧光能量可以向受体转移,表现为受体的荧光增强,同时供体自身的荧光衰减。这就是荧光共振能量转移(FRET)。FRET 程度与供、受体分子的空间距离紧密相关,随着距离延长, FRET显著减弱。而FRET速率与两个分子间的距离成正比。利用这种供体和受体分子之间非辐射能量转移的原理,FRET可以作为“光谱标尺”,用来确定两个荧光分子的接近程度。
Theodor F?rster在1960年最早提出了FRET,并通过Stryer & Haugland(1967)等人的实验得到证实。通过单分子FRET技术,我们能在单个分子内或分子复合物中,以纳米尺度实时追踪变化,了解目标分子在细胞内的空间分布,从而帮助解答许多重要的生物学问题。目前单分子FRET已经成为研究蛋白质&核酸结构和动力学的理想技术。包括观察酶在其功能周期中的构象变化 (Dyla et al. 2016),实时监测DNA合成 (Fijen et al. 2017)等。
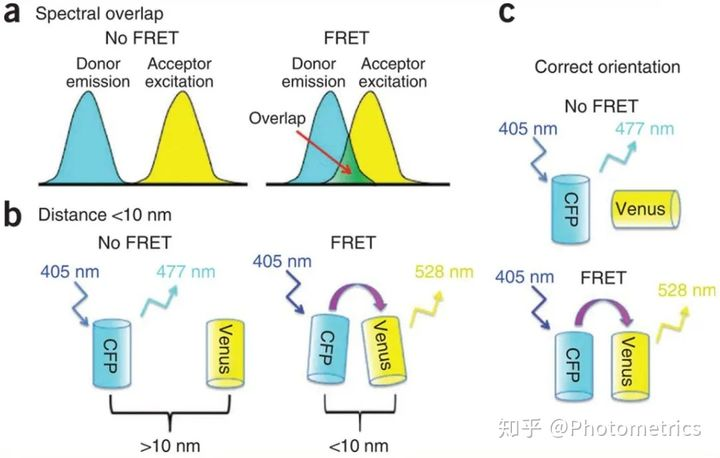
图3 发生FRET必须满足的三个最重要的条件:(a)供体的发射光谱必须与受体的激发光谱重叠。(b)供体和受体距离<10nm(c)供体和受体荧光双极相互平行。(Broussard et al.2013年)
PALM/STORM
除了TIRF和FRET,我们在超分辨专题中给大家介绍的光激活定位显微技术(PALM)和随机光学重建显微技术(STORM)也是单分子荧光成像技术。这里就不多做赘述,大家可以阅读我们之前的技术文章前沿显微成像技术专题——超分辨显微成像(1)复习一下~
由于单个荧光基团的信号强度本身已经很弱,对信噪比的挑战很大。有时单分子成像还需要很快的速度,曝光时间较短,进一步降低信号强度。因此,决定单分子荧光成像质量的一个最重要的因素就是能否从背景噪声中检测出微弱的信号——这就需要高灵敏度、低噪声和高速的检测设备了。
EMCCD 曾经是单分子荧光成像的首选,这是因为它95%的量子效率和电子倍增过程带来的高信噪比。然而,由于存在增益衰减,EMCCD 的成像效果不稳定,信噪比也会收到电子倍增过程带来的额外噪声的影响而降低。
随着科学相机技术的飞速发展,背照式 sCMOS 相机诞生了。它和 EMCCD 一样具有95%量子效率和极低的读出噪声,但是不存在EMCCD增益衰减和额外噪声的问题,因此能够保证以极高的信噪比检测单分子荧光信号。同时,背照式 sCMOS在速度、视野和性价比上都具有很大的优势,因此,近年来越来越多的单分子荧光成像应用已经“移情别恋”,使用背照式 sCMOS 取代传统的 EMCCD,取得了非常好的成像效果。
单分子荧光技术的基础是用荧光染料对感兴趣的分子进行标记,标记方法和荧光染料的选择至关重要,需要根据样品和特定成像技术的需要进行选择。标记单个分子的方法有很多,包括抗体标记、生物素化、表位标记、小分子探针和生物正交标记等。一般来说,用于单分子成像的荧光染料应该满足以下要求:
常见的荧光染料包括有机染料(如FITC、TRITC)、荧光蛋白(如GFP、YFP)和量子点。当然,这些染料并不是完美的,也有着各自的优缺点,我们将在后面的文章中给大家做详细的介绍。
与集群研究相比,单分子荧光成像能够揭示单个分子的结构和功能。自从20世纪90年代单分子成像技术被广泛应用以来,已经开发出许多新技术,包括效率更高的荧光染料和更灵敏的科学相机,使得单分子实验中信噪比低的问题得到了很好的解决。这也使得单分子荧光成像越来越受到欢迎。
标签:效果 信号 结合 影响 需要 优缺点 兴趣 特点 带来
原文地址:https://www.cnblogs.com/ybqjymy/p/14738805.html